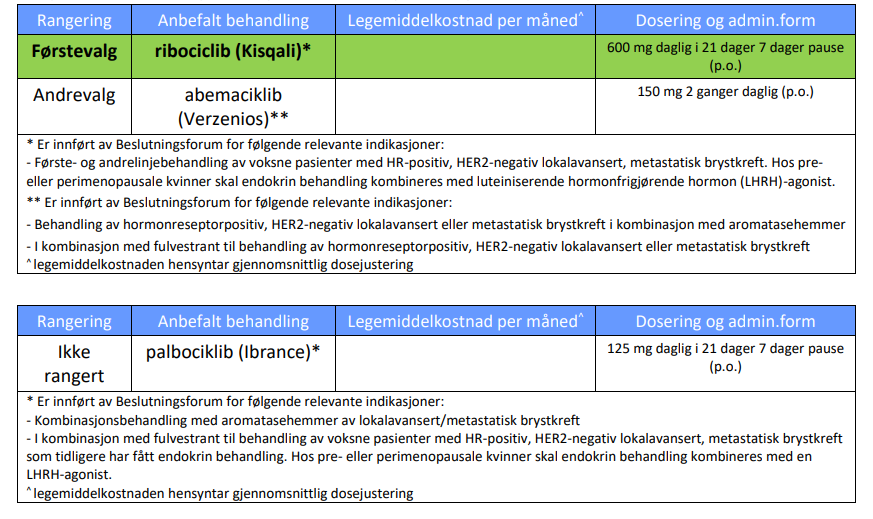
KISQALI® [1]
HR-positiv, HER2-negativ brystkreft med spredning: CDK 4/6-hemmere
Les hele 2407 avtalen her [2]
1. anbefaling-onkologiske-og-kolonistimulerende-legemidler.pdf (sykehusinnkjop.no) [2] sist lest 08.10.2024
Indikasjon
KISQALI® er indisert for behandling av kvinner med HR+, HER2- lokalavansert eller metastatisk brystkreft sammen med aromatasehemmer eller fulvestrant, som innledende endokrinbasert behandling, eller hos kvinner som tidligere har fått endokrin behandling.
Hos pre- eller perimenopausale kvinner skal endokrin behandling kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.
Dosering
KISQALI i kombinasjon med aromatasehemmer
• De fleste pasientene starter med en dose på 600 mg (3 KISQALI tabletter à 200 mg) + aromatasehemmer samtidig.
• Pasientene må ta KISQALI® + en aromatasehemmer i tre uker. I uke fire tas kun aromatasehemmeren. Deretter gjentas syklusen.*
* Se fullstendig SPC for aromatasehemmer for ytterligere informasjon.

Illustrasjon utarbeidet av Novartis
KISQALI i kombinasjon med fulvestrant
Anbefalt dose er 600 mg (tre tabletter à 200 mg) + fulvestrant som skal administreres intramuskulært dag 1, 15 og 29, deretter en gang i måneden.
** Se fullstendig SPC for fulvestrant for ytterligere informasjon.

Illustrasjon utarbeidet av Novartis
Monitorering med Kisqali
Pasientene skal følges opp med jevnlige kontroller under behandling med Kisqali, spesielt de første månedene. Dette omfatter blant annet blodprøver for å overvåke benmargens og leverens funksjon. I tillegg skal elektrolyttstatus observeres og det skal utføres to EKG-kontroller i løpet av pasientens første måned. Dette skal gjøres på dag 1 og dag 14 i første syklus, deretter ved behov (se skjema *).
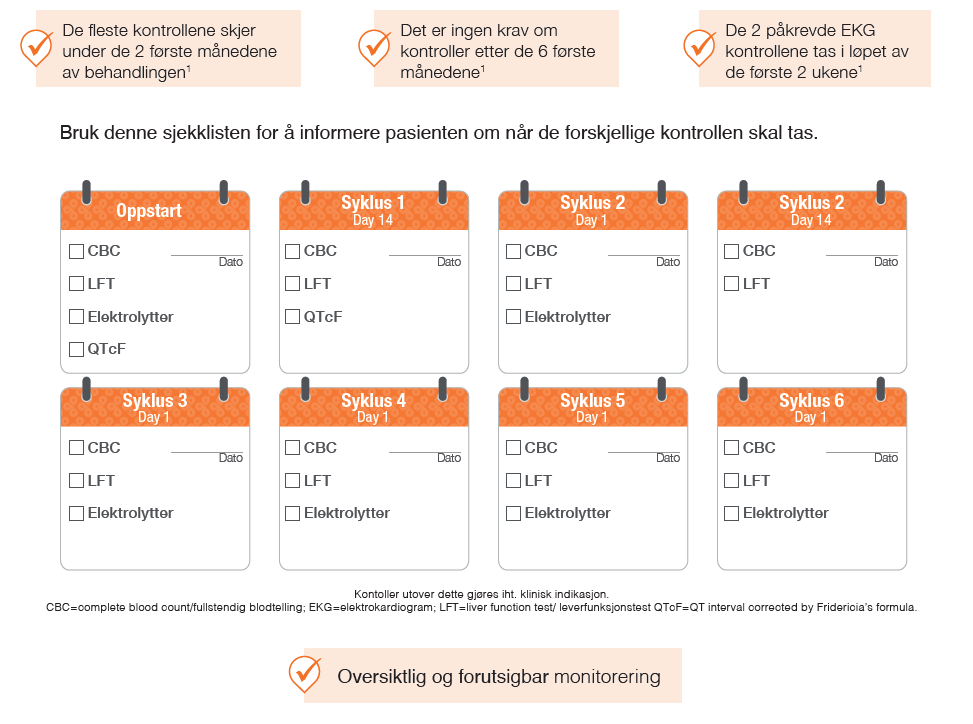
Illustrasjon utarbeidet av Novartis
Dosereduksjon

Illustrasjon utarbeidet av Novartis
Effekt og sikkerhet ved bruk av Kisqali
Effekt og sikkerhet ved bruk av Kisqali har blitt studert i tre store fase-3-studier med, til sammen, over 2000 pasienter. Monaleesa studieprogrammet består av tre store randomiserte, dobbeltblindede, placebokontrollerte, klinisk fase III-multisenterstudier. De endelige totaloverlevelse analysene (OS, overall survival) fra de tre fase-3 studiene, viste til en signifikant overlevelsesgevinst.3,4,5
Kisqali viste gjennom disse studiene at pasienter med metastatisk brystkreft hadde ca 1 år lenger overlevelse enn med komparator alene.3,4,5
Monaleesa-2: førstelinjebehandling til pasienter som ikke hadde fått tidligere behandling for metastatisk sykdom, i kombinasjon med letrozol sammenlignet med letrozol alene.3,4,5
Monaleesa-3: første- og andrelinjebehandling til pasienter som hadde fått ingen eller kun én linje med tidligere endokrin behandling i kombinasjon med fulvestrant vs. fulvestrant alene.3,4,5
Monaleesa-7: førstelinjebehandling til pre- og perimenopausale kvinner. Pasientene fikk enten en ikke-steroid aromatasehemmer eller tamoksifen og goserelin vs. placebo i kombinasjon med en ikke-steroid aromatasehemmer eller tamoksifen og goserelin.3,4,5
Kisqali har har med dette vist en konsistent overlevelsesgevinst for både pre-, peri- og postmenopausale brystkreftpasienter. Kisqali kan benyttes som førstelinjebehandling sammen med valgfri aromatasehemmer eller fulvestrant, eller som andrelinjebehandling sammen med fulvestrant.3,4,5
Bivirkninger
De vanligste bivirkningene av grad 3/4 var nøytropeni, leukopeni, unormale leverfunksjonstester, lymfopeni, infeksjoner, ryggsmerter, anemi, fatigue, hypofosfatemi og oppkast.2
Utvalgt sikkerhetsinformasjon
Kisqali er kontraindisert ved overfølsomhet for innholdsstoffene, peanøtter eller soya. Kisqali bør unngås ved eksisterende eller signifikant risiko for utvikling av QTC-forlengelse. Vær oppmerksom på tegn til lungebetennelse, da interstitiell lungesykdom/pneumonitt er observert under behandling. Kisqali metaboliseres hovedsakelig av CYP3A4 og dosereduksjoner kan være aktuelt. Behandlingen med Kisqali krever monitorering under de første behandlingssyklusene.7 Eldre > 65 år: Dosejustering ikke nødvendig. Kan tas med eller uten mat.
Pakninger og priser: 21 stk. (blister) 17 685,50. 42 stk. (blister) 35 336,10. 63 stk. (blister) 52 986,60.
Refusjon: H-resept: L01E F02_1 Ribosiklib.
Referanser:
-
1. anbefaling-onkologiske-og-kolonistimulerende-legemidler.pdf (sykehusinnkjop.no) [2] sist lest 08.10.2024
-
Kisqali SPC Avsnitt 4.1, 4.2, 4.3, 4.4, 4.5, 4.8, 5.1,
-
Im S-A Lu, Bardia A, et al,Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med 2019; 381: 307-16.
-
Slamon DJ, Neven P, Chia S et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med 2019; DOI: 10.1056/NEJMoa1911149
-
N Engl J Med 2022;386:942-50. DOI: 10.1056/NEJMoa2114663